細胞移動の多くは,細胞や細胞外基質(※2)が密に詰まった立体的な組織の内部で生じます。本研究グループは,このような三次元的な細胞移動の仕組みを理解するため,コンピュータを使って多数の細胞の三次元的な動きを予測する,新しいシミュレーション技術を開発しました。このシミュレーション技術により,コンピュータ内のバーチャルな世界で細胞の動きを再現し,その仕組みを予測できるようになりました(図1)。さらに,このコンピュータ内のバーチャルな世界で仮想的な実験を繰り返すことによって,未知であった細胞が動く仕組みを解明しました。
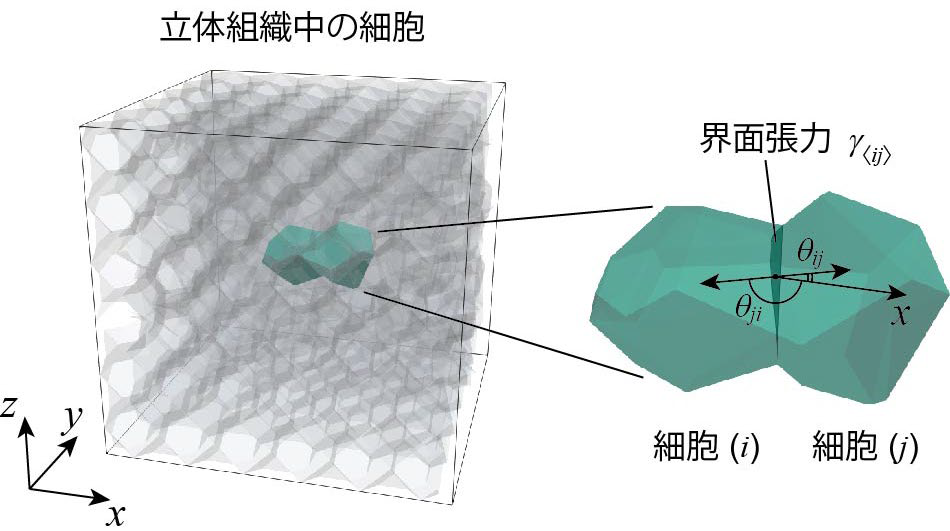
図1 独自開発したシミュレーション技術と数理モデリング
研究の結果,一つ一つの細胞で偏った界面張力が細胞や細胞塊(クラスター)の移動を引き起こすことが分かりました(図2)。また,この細胞移動の過程では,一つ一つの細胞で偏った界面張力は,細胞と周囲との界面に一方向的な流れを生じることで,細胞やクラスターの推進力を生み出していました(図3)。さらに,クラスターが移動する際には,クラスター内部の細胞の相対的な位置が保たれていることが分かりました。
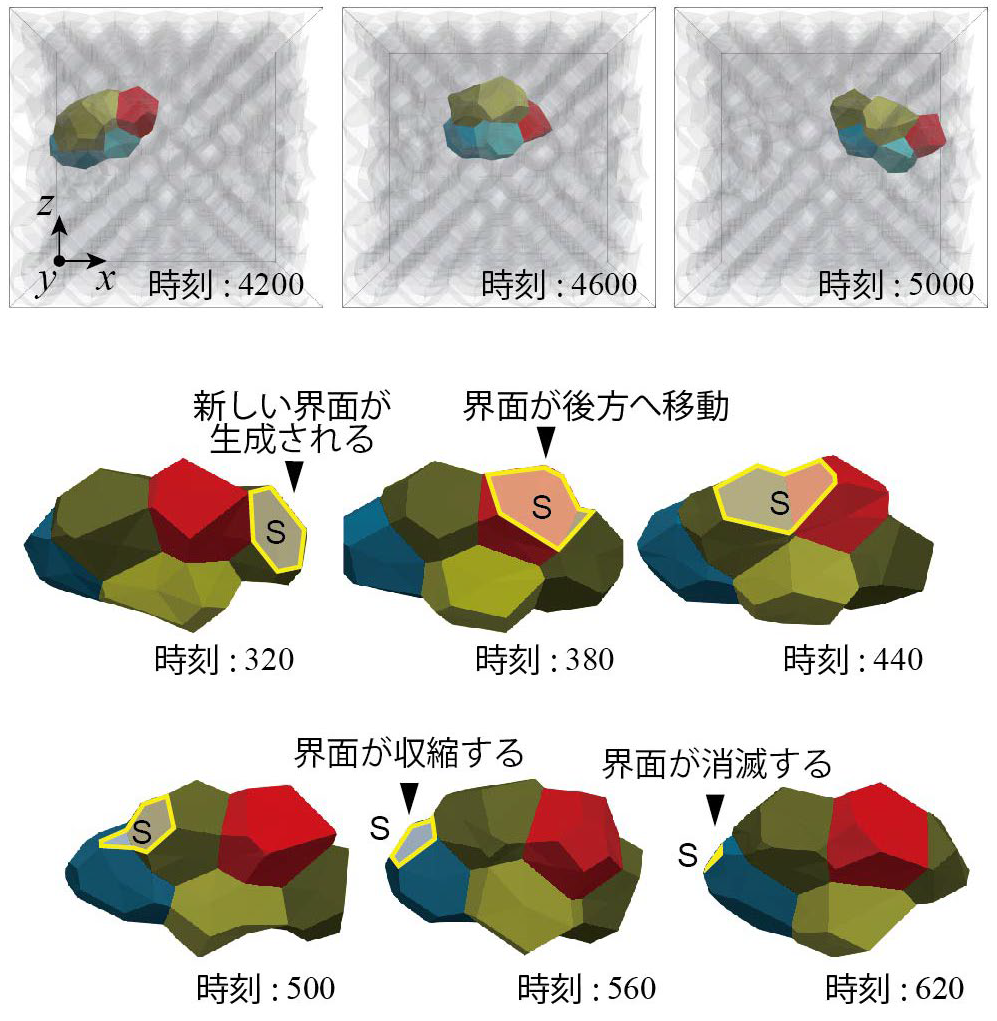
図2 シミュレーションで再現された細胞の動き
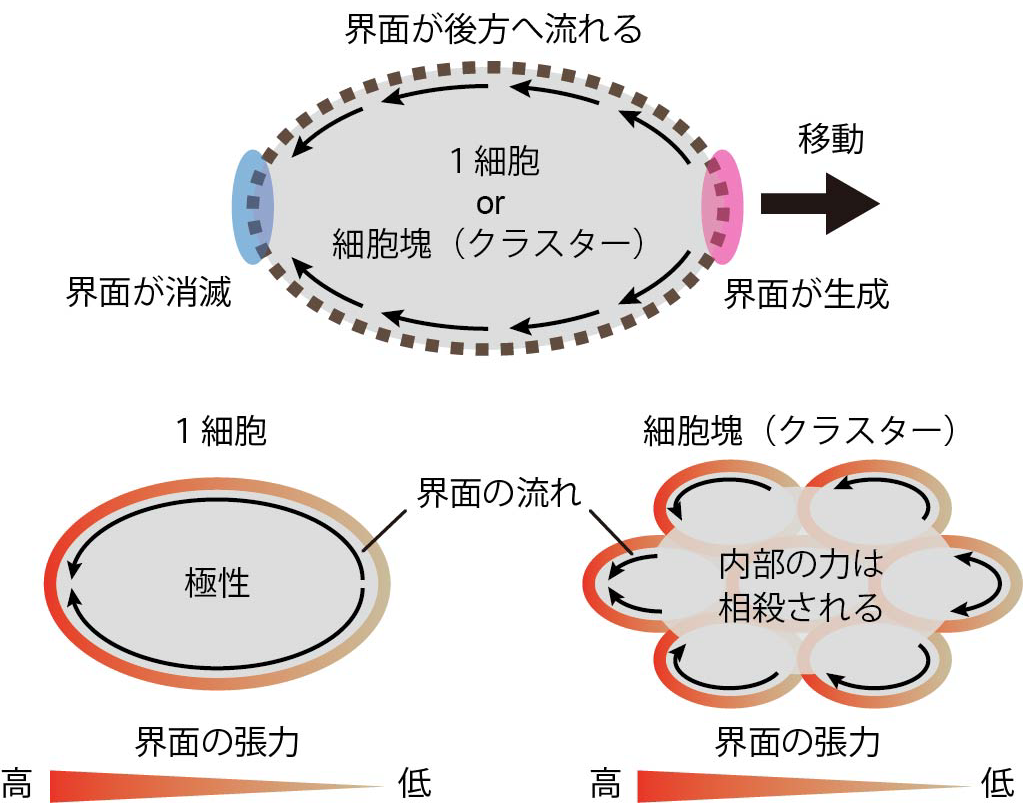
図3 立体組織中における細胞や細胞集団の運動の仕組み
本研究グループが行ったコンピュータシミュレーションにより,がん浸潤や胚発生にみられる複数の異なる動きのパターンが再現され,各パターンが生じる物理的な条件が特定されました(図4)。例えば,複数の細胞がバラバラに移動するパターン,クラスターとなって移動するパターン,数珠状に連なって移動するパターンです。特に,数珠状の移動スピードは,クラスター状のものよりも大きくなっており,がん浸潤の悪性度の高さとも対応します。
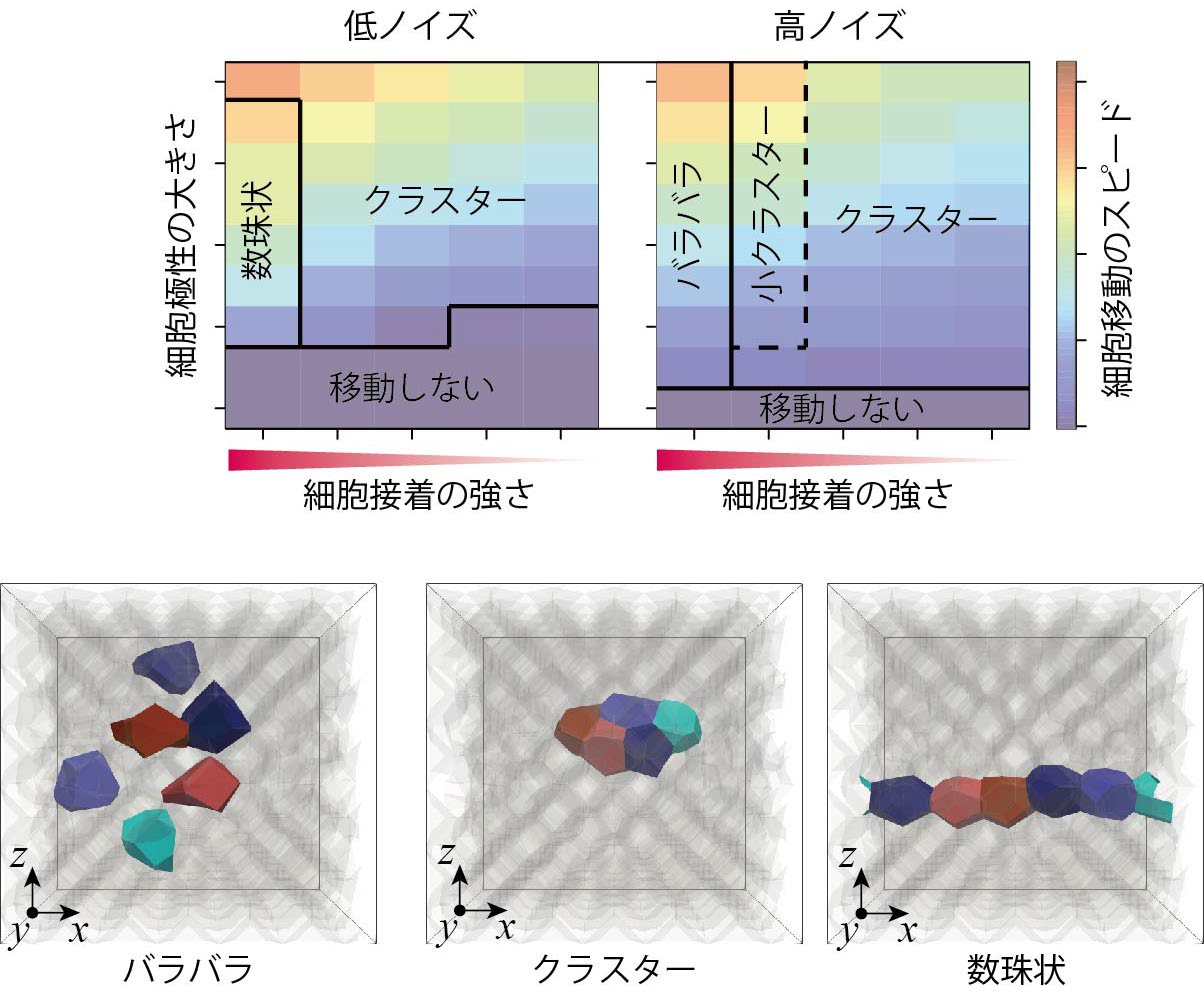
図4 再現された複数の細胞運動パターンとその条件





