


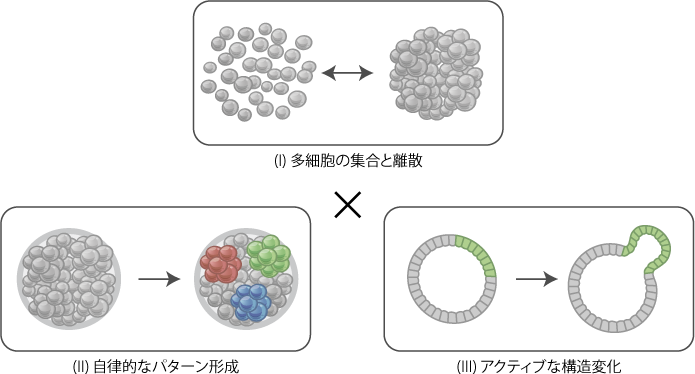

試験管の中で幹細胞を培養し、器官様の立体組織(オルガノイド)を作ることで、胚発生やがん疾患における多細胞の振る舞いの理解に取り組んでいます。遺伝子改編技術や蛍光イメージング技術などを駆使し、自己組織化における多細胞ダイナミクスの分子生物学的・細胞生物学的・生体力学的な理解を目指しています。
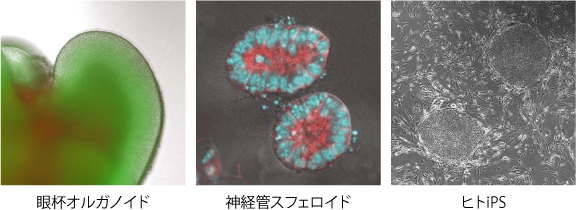
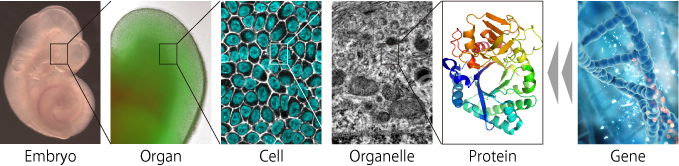
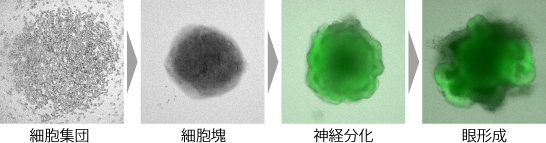
多細胞に内在する自己組織化の能力を利用して、多能性幹細胞から器官様の立体組織を誘導するオルガノイド技術が確立されました(Eiraku, et al Cell Stem Cell 2008)。特に、オルガノイド技術の先駆けである眼杯オルガノイドでは、胚性幹細胞から複数種の細胞が分化し、眼杯組織の立体的な秩序構造が自律的に形成される(Eiraku, et al, Nature 2011,私たちも参画)。このような多細胞の自己組織化能力を強く反映する眼杯オルガノイドの特性に着目し、器官形成における自己組織化の原理的な理解を目指しています。
がん疾患に関わる研究のほとんどは遺伝子や分子に着目した研究がほとんどです。しかし、既存の分子生物学的な理解だけでは、がん細胞の腫瘍形成や浸潤伸展の仕組みを理解することは困難です。そこで私たちは、金沢大学がん進展制御研究所との共同で、腸オルガノイドを用いた腫瘍形成・浸潤進展の機構解明に取り組んでいます。特に私たちは、既存の遺伝子改編技術や蛍光イメージング技術に加えて、機械工学的な技術を導入することにより、がん疾患に鍵となる細胞の変形や運動に関する新しい理解に挑んでいます。
機械工学的な精密操作(ピエゾマニピュレータや原子間力顕微鏡(AFM)など)によって、作成した立体組織の局所に対して力学的・生化学的な摂動を加える技術を開発しています。この摂動技術と3D組織の培養技術を組み合わせた実験により、自己組織化の鍵となる分子-細胞-組織間のスケールを相互作用の理解と組織工学への応用を目指しています。
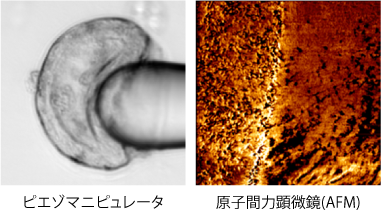
器官の形ができたり細胞が運動したりする仕組みを理解するためには、その物理的・生化学的な特性を理解する必要があります。私たちは、ピエゾマニピュレータを使って培養中の細胞や3D組織を自由自在に制御する技術を開発しています。この開発した技術によって、3D組織の機械特性やアクティブな応答など、新しい現象の発見を目指しています。
現在の生物学では、組織内の遺伝子発現を網羅的に解析することが可能になり、膨大なデータが蓄積されています。しかし、組織内の物理的な特性や微細な構造についてはほとんど分かっていません。そこで我々は、器官発生やがん疾患をより包括的に理解するため、AFMによって組織内の物理的な特性や微細な構造を計測する新規技術の開発と応用に取り組んでいます。
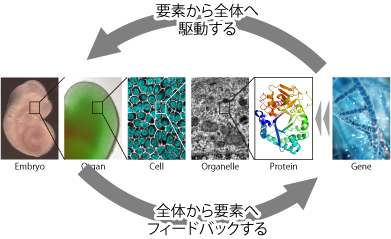
器官形成やがん形成などの多細胞の三次元動態を分子・細胞・組織のスケールから統合的に解析するため、新しい計算機シミュレーション手法を開発しています。これらの手法を器官形成やがん形成などの現象に適用することにより、多数の分子・細胞から成る組織・器官の動態を網羅的・定量的に予測することを目指しています。

多細胞の3D動態をシングルセル解像度で記述する3Dバーテックスモデルの開発と応用を行っています。本モデルは発泡体の動態を記述する粗視化モデルの一つで,その原型は1956年頃に提案されました。1990年頃に泡動態の解析に用いられ、2004年頃には本多久夫先生らにより生命現象へ応用されました。私たちは、この数理モデルを大きく発展させ、各細胞の変形、運動、成長、分裂、細胞死、シグナル伝達を記述し、巨大な組織や器官の動態を1細胞レベルで解析することが可能になりました。
胚発生やがん疾患などは数時間~数日の長時間スケールで生じる現象ですが、それらはマイクロスケールの微細な細胞動態に起因します。そこで、このような長時間・微細空間の多細胞3D動態を記述する非保存流体膜モデルの開発と応用を行っています。既存の数理モデルは細胞膜を弾性体として記述するため、極めて短時間の細胞動態にしか適用することができませんでした。開発した私たちの手法は、細胞膜を非保存系の流動膜として表現することで、胚発生やがん疾患における長時間の多細胞動態を予測することが可能になりました。
力学シミュレーションや立体組織培養実験で得られた複雑なデータや知見に基づいて、多様な多細胞動態の素過程を抽出し、その定式化を行っています。これにより、胚発生やがん疾患などの幅広い多細胞ダイナミクスに共通した原理の発見を目指しています。