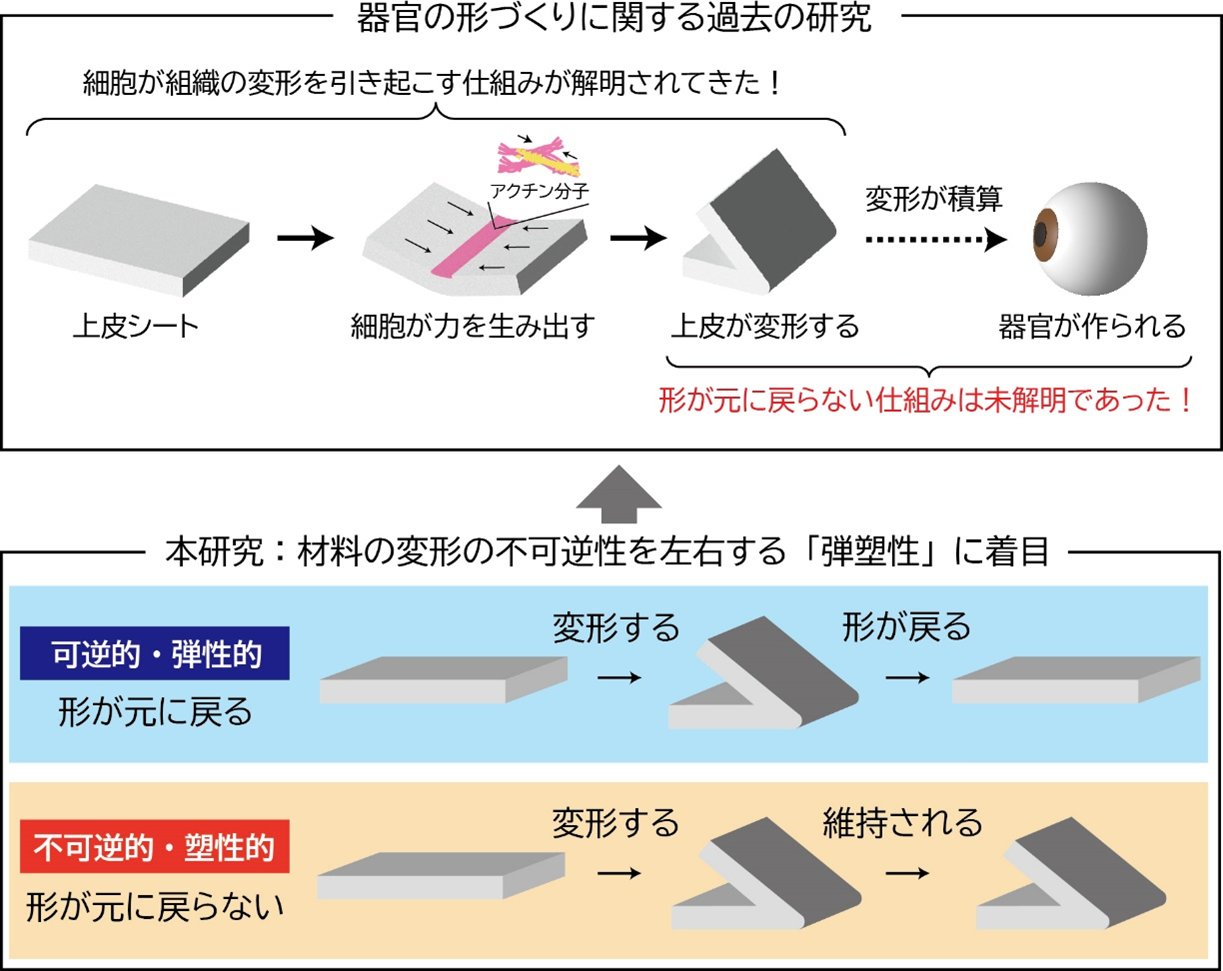
本研究では、細胞培養技術とマイクロ操作技術を組み合わせ、生きた上皮シートに対して複雑な三次元変形を加える新しい技術を開発しました。この技術により、上皮シートの折り目の弾塑性を計測することが可能になりました。具体的には、培養チャンバー内にピエゾマニピュレータ(※7)を設置してガラスピペットを操作し、立体的な上皮シートに折り目を作成しました。その後、ガラスピペットを一定時間保持し、ピペットを引き離した後に折り目が元に戻るかどうかを観察しました。
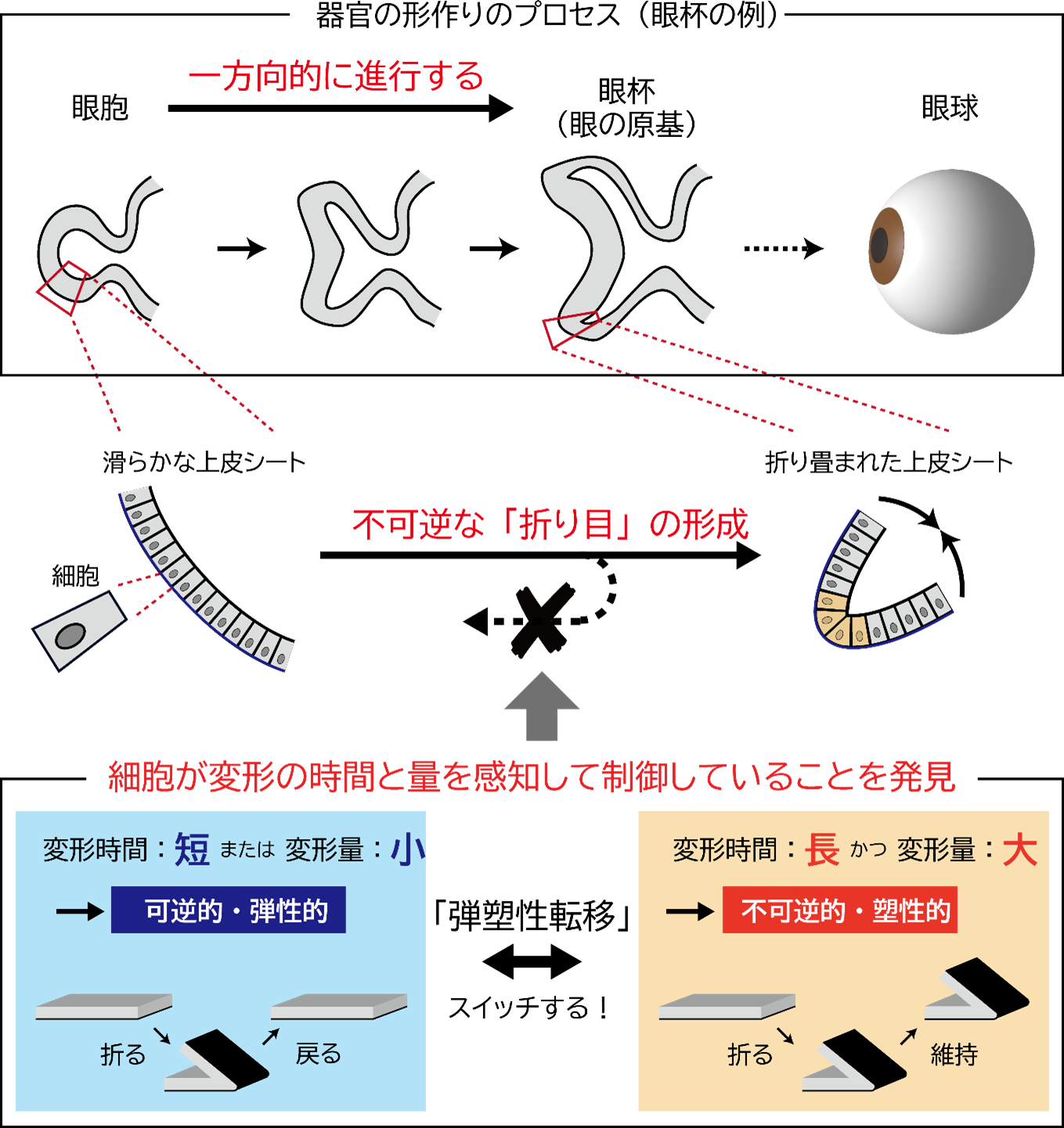
実験の結果、上皮シートの折り目が不可逆となる過程は、変形を加える「時間」と「変形量」によってスイッチのように変化することを初めて発見しました。特に、変形を加える時間が13分を超え、かつ、変形量(曲率)が0.13μm
-1を超えた場合、折り目は元に戻らず(不可逆/塑性的に)保持されることが分かりました。一方で、時間や変形量が閾値に満たない場合は、折り目が元に戻る(可逆/弾性的に)ことも明らかになりました。さらに、これらの弾性的・塑性的な応答は、閾値付近でスイッチのように急激に変化するため、この現象を「弾塑性転移」と名付けました。これらの結果から、上皮シートを構成する細胞は、加えられた変形の時間と量を感知し、弾性的または塑性的な応答を切り替えるメカニズムを持つと示唆されます。
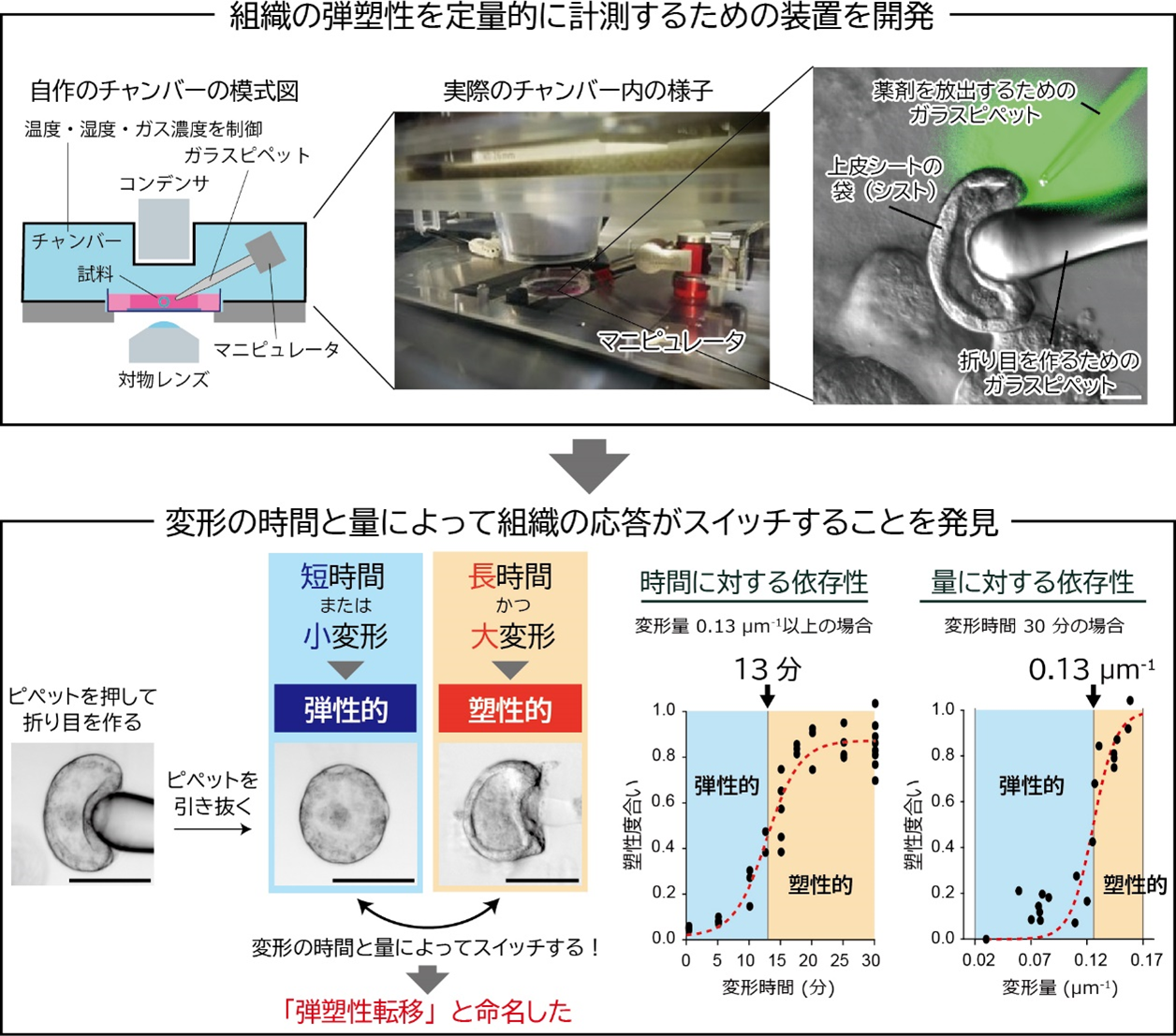
図3 上皮シートが変形の時間と量に依存して弾塑性転移を引き起こすことを発見
細胞が上皮シートに加えられた変形の「時間」と「量」をどのように感知するのかを解明するため、制御分子のライブイメージング観察(※8)と薬剤処理による分子機能阻害実験を行いました。その結果、上皮シートに与えられた変形量が閾値を超えると、二つの分子シグナルが活性化されることを発見しました。一つ目は、成長因子受容体であるEGFR(※9)とその下流のPI3kおよびAktです。二つ目は、機械刺激受容チャネル(※10)であるTRPC3/6と、その下流で生じるカルシウム発火(細胞内のカルシウム濃度が一過的に上昇する現象)です。特に、カルシウム発火は上皮シートの折り目の内側(頂端面)で特異的に生じることが確認されました。これらの二つの分子シグナルは、弾塑性転移に必須であり、細胞がこれらのシグナルを通じて、上皮シートに加えられた変形を感知していることが解明されました。
最後に、細胞が弾性的または塑性的な応答を切り替えるメカニズムを探るため、細胞の形の維持や変形に重要なアクチン分子に着目しました。ライブイメージング観察の結果、アクチン分子が折り目の内側(頂端面)に集まり、L字金具のような「アクチンブラケット」構造を形成する現象を発見しました。また、分子機能阻害実験によって、このアクチンブラケットが弾塑性転移を引き起こしていること、そしてその形成時間を操作することで、弾塑性転移の時間を制御できることを突き止めました。これらの結果から、細胞は分子シグナルを介して上皮シートに加えられた変形の時間と量を感知し、アクチンブラケットを形成することで、折り目の不可逆性を調整していることが明らかになりました。
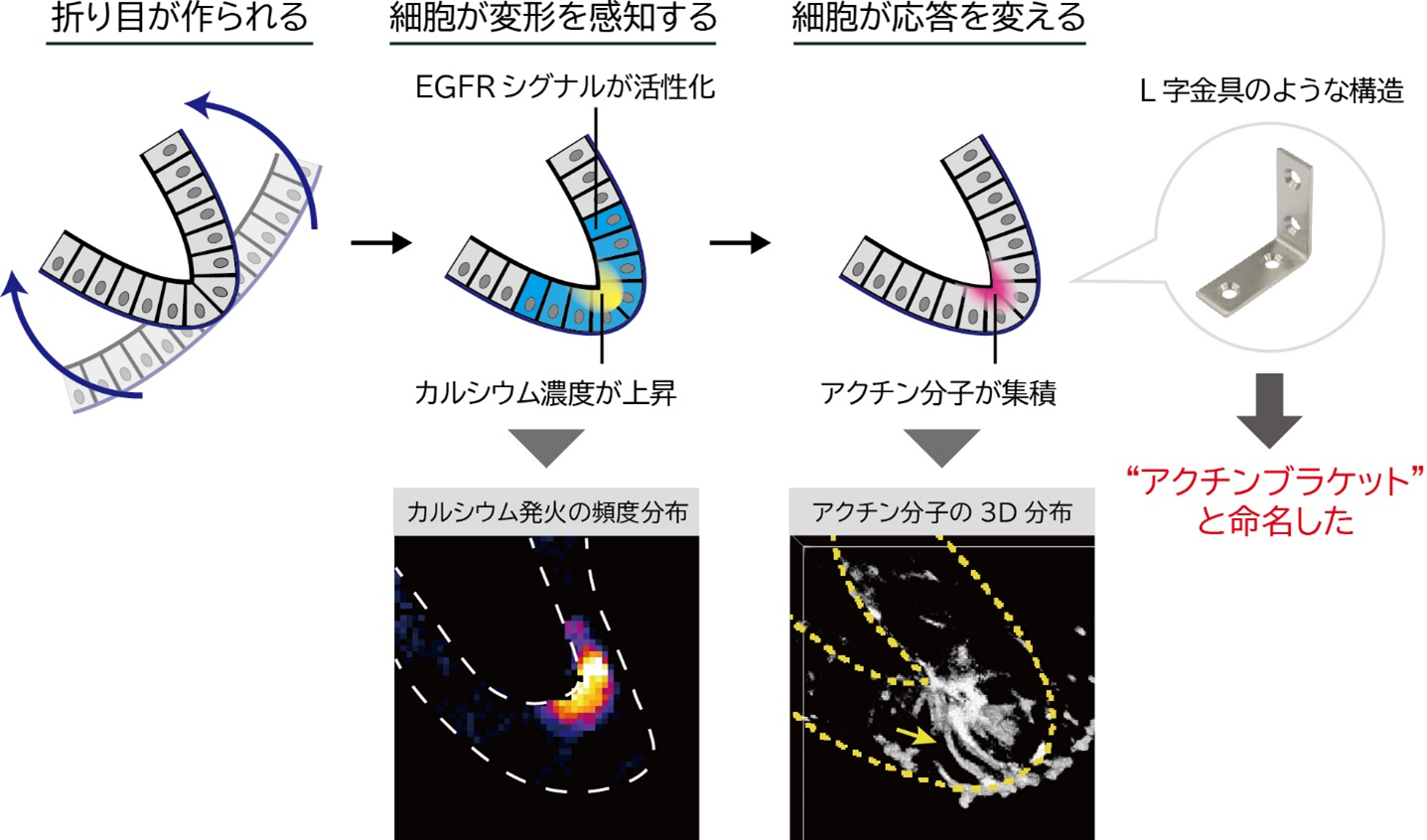
図4 細胞が変形の時間と量を感知してアクチンブラケット構造を形成することを発見